Esquivant bales màgiques
L’evolució de la resistència a antibiòtics en els bacteris
Els bacteris resistents a antibiòtics representen un dels principals problemes actuals de salut pública i prediccions recents indiquen que prompte es convertiran en la primera causa de mortalitat al món. El funest recorregut des de la introducció dels antibiòtics en la pràctica clínica fins a l’actual amenaça d’una era postantibiòtica s’ha transitat en tan sols unes poques dècades. Així, l’evolució de la resistència als antibiòtics és probablement l’exemple més espectacular d’evolució d’innovacions en un sistema biològic que hem pogut observar en temps real. En aquest article discutim algunes de les claus evolutives i moleculars que han permès als bacteris recórrer aquest camí.
Paraules clau: innovació evolutiva, resistència a antibiòtics, bacteris, plasmidis, transferència genètica horitzontal.
Introducció
La capacitat dels éssers vius per a explotar noves oportunitats ecològiques depèn de la seua habilitat per a innovar. L’evolució d’innovacions consisteix en l’adquisició de nous caràcters que permeten als organismes expandir el seu nínxol i afrontar nous reptes ambientals. Alguns exemples clàssics d’innovació evolutiva són l’aparició de les flors en les plantes o de la capacitat per a volar en els animals (Mayr, 1963). En molts casos aquestes innovacions són òbvies a nivell fenotípic, fins i tot espectaculars; només cal alçar la vista i observar un esbart d’ocells travessant el cel per a comprovar-ho. No obstant això, les bases moleculars que subjauen a aquestes adaptacions no són tan evidents. Com es generen les innovacions? Quines són les bases genètiques d’aquest procés? Aquestes preguntes han estat objecte d’estudi durant dècades i continuen obertes malgrat tot el que hem après sobre aquest tema (per a més informació sobre l’origen de les innovacions, vegeu Wagner, 2015). En aquest article intentarem il·lustrar algunes de les claus del procés d’innovació evolutiva per mitjà d’un dels exemples més dramàtics de què disposem actualment: l’evolució de resistència a antibiòtics en els bacteris.
«700.000 persones moren cada any al món com a conseqüència d’infeccions resistents als antibiòtics»
Un advertiment desatès
Els antibiòtics són sense lloc a dubte un dels descobriments de major rellevància en la història de la humanitat. Aquestes «bales màgiques», com les va definir Paul Ehrlich ja a començament del segle xx (Tan i Grimes, 2010), són molècules capaces d’inhibir específicament el creixement bacterià i han representat la base per al desenvolupament de la medicina i la cirurgia modernes. I és que, de fet, semblen bales màgiques; els antibiòtics són increïblement eficients en el tractament d’infeccions bacterianes. Paradoxalment, aquesta gran efectivitat ha estat també l’origen del seu declivi, ja que durant dècades s’ha fet un ús desmesurat i en molts casos inadequat d’aquest recurs tan preuat, i això ha promogut l’evolució de la resistència a antibiòtics en els bacteris. Aquest fenomen no hauria de sorprendre’ns, ja que, en el seu discurs d’acceptació del Premi Nobel en 1945, Alexander Fleming ja ens va avisar de l’habilitat dels microorganismes per a adquirir resistència a antibiòtics i del perill que això representava (Fleming, 1945). Desgraciadament, aquest advertiment no ha estat atès, i l’abús dels antibiòtics des que es van introduir en la pràctica clínica a mitjan segle passat ha conduït a un increment constant de les freqüències de resistència en els patògens bacterians. De fet, la disseminació de la resistència a antibiòtics entre patògens d’interès clínic s’ha convertit en un dels principals problemes actuals de salut pública (Figura 1), com reconeixen totes les organitzacions internacionals de salut, les Nacions Unides i fins i tot el Fons Monetari Internacional (CDC, 2013; ECDC, 2013; Jonas, Parry, Chisholm, Banatvala i Ladminarayan, 2014; OMS, 2016). Per exemple, l’Organització Mundial de la Salut subratlla que «si no es prenen mesures urgents, el món es dirigeix cap a una era postantibiòtica en la qual moltes infeccions corrents i lesions menors esdevindran de nou potencialment mortals» (OMS, 2018). D’acord amb estimacions recents, aproximadament 700.000 persones moren cada any al món com a conseqüència d’infeccions resistents als antibiòtics (O’Neill, 2016). Aquestes prediccions també indiquen que, si no es reverteix la tendència actual de disseminació de la resistència a antibiòtics, per al 2050 les infeccions resistents podrien convertir-se en la primera causa de mortalitat al món i provocar deu milions de morts anuals.
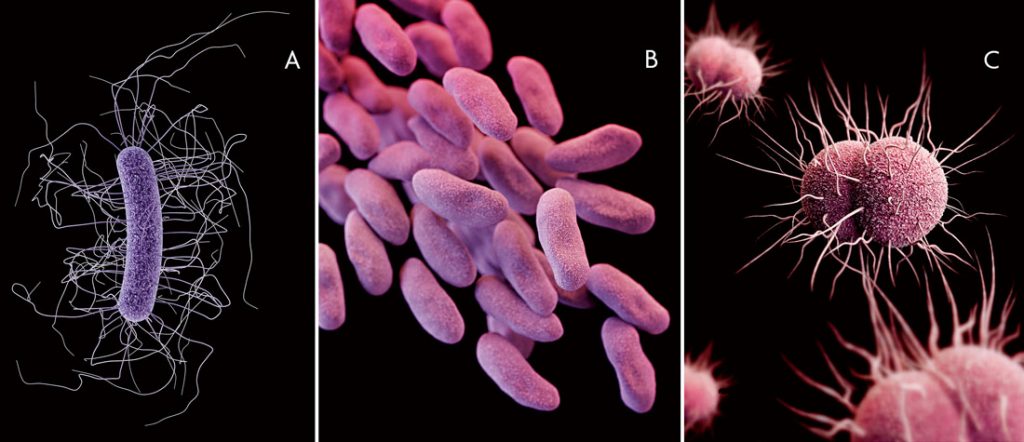
Figura 1. En 2013, el Centre de Control i Prevenció de Malalties dels Estats Units (CDC en les seues sigles en anglès) va llançar un informe en què catalogava les principals amenaces per a la salut pública provocades per la resistència a antibiòtics entre patògens d’interès clínic (CDC, 2013). En la imatge, il·lustracions en 3D de l’estructura dels tres bacteris qualificats d’«amenaça urgent» en aquest informe (d’esquerra a dreta): A) Clostridium difficile (que pot causar colitis i diarrea de gravetat); B) clons pertanyents a la família Enterobacteriaceae ressistents a antibiòtics carbapenèmics, i C) soques resistents a antibiòtics de Neisseria gonorrhoeae (l’agent causal de la gonorrea). / CDC / James Archer
Adaptant-se als antibiòtics
L’evolució de la resistència a antibiòtics en els bacteris és un exemple simple i elegant d’adaptació mitjançant selecció natural (Figura 2). Un bacteri adquireix un mecanisme de resistència que és seleccionat en presència de l’antibiòtic. En absència de l’antibiòtic, el mecanisme de resistència generalment produeix un cost biològic en termes d’una reducció del fitness o eficàcia biològica del bacteri (definida com una disminució de la seua taxa reproductiva). No obstant això, aquesta reducció d’eficàcia biològica es pot corregir mitjançant mutacions compensatòries que alleugen el cost associat amb la resistència. Considerant aquesta dinàmica, és fàcil comprendre que l’ús excessiu d’antibiòtics ha promogut la disseminació de la resistència a antibiòtics a escala global.
«Per al 2050, les infeccions resistents podrien convertir-se en la primera causa de mortalitat al món»
La resistència a antibiòtics és, per tant, un exemple fascinant d’evolució d’innovacions, ja que un bacteri sensible a un antibiòtic necessita innovar per a adquirir la resistència. El que és encara més fascinant és el fet que per a estudiar aquesta innovació evolutiva no necessitem investigar restes fòssils, ja que l’hem presenciada en temps real, durant les últimes dècades. És més, podem fins i tot reproduir parcialment aquest procés d’evolució en els nostres laboratoris, utilitzant l’anomenada «evolució experimental» (Buckling, Craig Maclean, Brockhurst i Colegrave, 2009). Finalment, i aquest és un punt crucial, gràcies als avanços tecnològics, avui dia podem determinar exactament quines són les bases genètiques que subjauen a l’evolució de la resistència a antibiòtics en els bacteris. En definitiva, tot el que hem exposat anteriorment ens situa en una posició ideal per a respondre algunes de les preguntes clau sobre l’evolució d’innovacions responsables de la resistència a antibiòtics, i així ho intentarem en les pròximes línies.
Rutes cap a la resistència
L’adquisició de resistència a antibiòtics en els bacteris pot seguir fonamentalment dues rutes: a) mutacions cromosòmiques i b) l’adquisició de mecanismes específics de resistència mitjançant transferència genètica horitzontal (Figura 3). Aquests dos processos són fonamentalment diferents en diversos aspectes clau. Les mutacions cromosòmiques consisteixen en alteracions en els gens codificats pel bacteri que desemboquen en un fenotip de resistència als antibiòtics. Aquest és un poderós mecanisme adaptatiu, atesa l’alta taxa de mutació constitutiva dels bacteris (que es veu, a més, incrementada en presència d’alguns antibiòtics) i la gran grandària de les poblacions bacterianes (que augmenta les probabilitats que almenys un individu de la població adquirisca la mutació adequada).

Les mutacions que confereixen resistència poden afectar les dianes cel·lulars dels antibiòtics, i modificar-les perquè aquests no les reconeguen. Per exemple, si el mecanisme d’acció d’un antibiòtic es basa en el bloqueig d’un enzim bacterià, les mutacions que alteren l’estructura d’aquest enzim, i per tant eviten el reconeixement per part de l’antibiòtic (i idealment sense alterar significativament la seua activitat), conduiran a la resistència. Un altre tipus de mutacions que confereixen resistència són aquelles que produeixen la disminució de la concentració intracel·lular dels antibiòtics a través de de l’expulsió o de la reducció de la captació d’aquests. En aquesta categoria s’inclouen, per exemple, mutacions que produeixen la sobreexpressió de bombes d’eflux que retiren activament l’antibiòtic del compartiment intracel·lular bacterià. En definitiva, l’adquisició de resistència a través de mutacions cromosòmiques es basa en l’alteració del material genètic preexistent en el bacteri i es transmeten de manera vertical a la descendència.

La segona ruta d’adquisició de resistència a antibiòtics és a través de transferència genètica horitzontal (TGH). La TGH és el moviment de material genètic entre organismes independent de l’herència vertical i consisteix bàsicament en l’intercanvi directe d’ADN entre individus. Aquest procés representa un paper crucial en l’evolució dels éssers vius i és particularment freqüent i rellevant en els bacteris, ja que alleuja la seua manca de reproducció sexual. La TGH en bacteris pot realitzar-se directament a través de la captació d’ADN nu del medi, que posteriorment es recombina amb el material genètic bacterià, en un procés conegut com a transformació. Més rellevant encara per a l’evolució d’innovacions en bacteris és la TGH vehiculada per elements genètics mòbils (EGM), que són estructures genètiques capaces de transferir-se activament entre bacteris. Entre aquests elements destaquen els virus bacteriòfags (o fags) i els plasmidis, que medien els processos coneguts com transducció i conjugació, respectivament (Figura 3). Els EGM porten els gens necessaris per al seu cicle biològic, però a més codifiquen múltiples gens accessoris amb elevat valor adaptatiu per als bacteris. D’aquesta manera, els EGM donen accés als bacteris receptors a un repertori de gens completament nous, de manera que els permet adaptar-se a nous nínxols ecològics i resistir diferents insults ambientals de manera pràcticament immediata. Imagineu poder adquirir el color d’ulls de la persona asseguda al vostre costat, l’olfacte del vostre gos o fins i tot les ales d’un ocell, en qüestió de minuts? Aquest és el poder de la TGH en els bacteris.

Figura 4. A més de la investigació en nous antibiòtics, es fa necessari promoure’n un ús més racional per a disminuir la pressió selectiva sobre les poblacions bacterianes. En aquest sentit, governs de tot el món estan llançant campanyes d’informació tant a la ciutadania com al personal mèdic per a acabar amb l’ús abusiu d’aquestes «bales màgiques». En la imatge, pòster de campanya del Pla Nacional davant de la Resistència als Antibiòtics, en actiu a Espanya des de 2014 i la segona fase del qual (2019-2021) acaba d’iniciar-se. / Ministeri de Sanitat, Serveis Socials i Igualtat. Govern d’Espanya
Els EGM de major rellevància en l’evolució de la resistència a antibiòtics en bacteris en els ambients clínics són els plasmidis (San Millán, 2018). Els plasmidis són petites molècules circulars d’ADN que es repliquen independentment del cromosoma bacterià i que es transfereixen a través d’un túnel proteic que estableix contacte directe entre bacteris en un procés conegut com a conjugació. Aquests elements genètics codifiquen sofisticats mecanismes de resistència, molts dels quals adquirits a partir dels bacteris ambientals que fa milions d’anys que produeixen els antibiòtics que utilitzem actualment als hospitals. I el que és més preocupant: aquests plasmidis porten normalment no un, sinó diversos mecanismes de resistència diferents, i confereixen així resistència a múltiples antibiòtics en un únic esdeveniment de conjugació. A més, els plasmidis es mantenen en múltiples còpies en els bacteris hoste i proporcionen un augment en la dosi dels gens que codifiquen, la qual cosa serveix de combustible per a l’evolució contínua d’innovacions a partir d’aquests (Rodríguez-Beltrán et al., 2018; San Millán, Escudero, Gifford, Mazel i MacLean, 2016). Per totes aquestes raons, la resistència a antibiòtics mediada per plasmidis ha emergit com un dels problemes de més difícil solució en els ambients clínics al llarg de les últimes dècades.
Conclusió
L’estudi de l’evolució de la resistència a antibiòtics ens està permetent comprendre algunes de les regles que governen l’evolució d’innovacions en els bacteris, i per extensió en la resta dels éssers vius. L’evolució de la resistència és testimoniatge de la increïble capacitat adaptativa dels bacteris, que normalment troben no una, sinó diverses solucions genètiques per a sobreviure als antibiòtics. Per tant, si volem continuar gaudint dels enormes beneficis d’aquestes bales màgiques en el futur és necessari promoure un ús més racional dels antibiòtics que contribuïsca a disminuir la pressió selectiva sobre les poblacions bacterianes (Figura 4). Finalment, el més fascinant del tema objecte d’aquest article probablement és el fet que, durant els minuts que heu tardat a llegir-lo, tots els mecanismes genètics d’adaptació que descrivim han ocorregut en temps real en el vostre tracte intestinal, en alguns dels aproximadament trenta bilions bacteris que l’habiten.
REFERÈNCIES
Buckling, A., Craig Maclean, R., Brockhurst, M. A., & Colegrave, N. (2009). The Beagle in a bottle. Nature, 457, 824–829. doi: 10.1038/nature07892
CDC. (2013). Antibiotic resistance threats in the United States. Centres for Disease Control and Prevention, US Department of Health and Human Services. Consultat en http://www.cdc.gov/drugresistance/threat-report-2013
ECDC. (2013). Annual epidemiological report 2012. Reporting on 2010 surveillance data and 2011 epidemic intelligence data. Estocolm: ECDC. Consultat en https://ecdc.europa.eu/en/publications-data/annual-epidemiological-report-2012-2010-data
Fleming, A. (1945, 11 de desembre). Penicillin. Nobel Lecture. NobelPrize.org. Consultat en https://www.nobelprize.org/uploads/2018/06/fleming-lecture.pdf
Jonas, O., Parry, I., Chisholm, D., Banatvala, N., & Ladminarayan, R. (2014). Global health threats of the 21st century. Finance and Development, 51(4), 16–20. Consultat en https://www.imf.org/external/pubs/ft/fandd/2014/12/jonas.htm
Mayr, E. (1963). Animal species and evolution. Cambridge, MA: Harvard University Press.
OMS. (2016). United Nations high-level meeting on antimicrobial resistance. Consultat en https://www.who.int/antimicrobial-resistance/events/UNGA-meeting-amr-sept2016/en/
OMS. (2018). Resistencia a los antibióticos. Consultat en https://www.who.int/es/news-room/fact-sheets/detail/resistencia-a-los-antibi%C3%B3ticos
O’Neill, J. (2016). Tackling drug-resistant infections globally: Final report and recommendations. Londres: Review on Antimicrobal Resistance.
Rodríguez-Beltrán, J., Hernández-Beltrán, J. C. R., DelaFuente, J., Escudero, J. A., Fuentes-Hernández, A., MacLean, R. C., … San Millán, A. (2018.) Multicopy plasmids allow bacteria to escape from fitness trade-offs during evolutionary innovation. Nature Ecology & Evolution, 2, 873–881. doi: 10.1038/s41559-018-0529-z
San Millán, A. (2018). Evolution of plasmid-mediated antibiotic resistance in the clinical context. Trends in Microbiology, 26(12), 978–985. doi: 10.1016/j.tim.2018.06.007
San Millán, A., Escudero, J. A., Gifford, D. R., Mazel, D., & MacLean R. C. (2016). Multicopy plasmids potentiate the evolution of antibiotic resistance in bacteria. Nature Ecology & Evolution, 1, 0010. doi: 10.1038/s41559-016-0010
Tan, S. Y., & Grimes, S. (2010). Paul Ehrlich (1854-1915): Man with the magic bullet. Singapore Medical Journal, 51(11), 842–843.
Wagner, A. (2015). Arrival of the fittest: How nature innovates. Nova York: Current.